Mecanismele care explică rezistența la tratament a cancerului ovarian dezvăluie noi modalități de îmbunătățire a tratamentului
©
Autor: Teodorescu Mihai
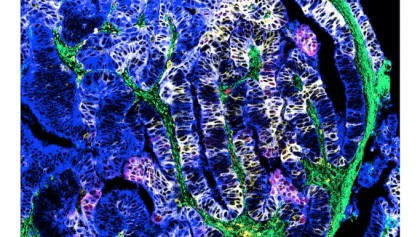
Cercetătorii s-au concentrat asupra enzimei indoleamină 2, 3-dioxigenază 1 (IDO1), responsabilă de degradarea aminoacidului triptofan, pentru a genera produse de degradare care pot suprima celulele imunitare (celulele T). Studiile anterioare au indicat că blocarea cu ajutorul unui medicament cunoscut sub numele de epacadostat a acțiunii IDO1 poate reactiva celulele T pe care tumora le oprește. Cu toate acestea, blocarea IDO1 cu ajutorul epacadostat, urmată de o terapie împotriva cancerului, a oferit rezultate mixte în studiile clinice, indicând o lacună în cunoașterea biologiei IDO1.
Pentru a înțelege mai bine modalitatea prin care cancerul previne atacul imunitar, cercetătorii au vrut să vadă exact ce se întâmplă în micromediul tumoral (TME), atunci când IDO1 este blocat. În prima etapă a studiului, oamenii de știință au colectat mostre de țesut de la paciente cu cancer ovarian avansat nou diagnosticat, care nu au suferit intervenții chirurgicale și nu au primit medicamente de chimioterapie. Ulterior, au colectat probe după ce pacienții au primit tratament cu un curs de două săptămâni de EPA și au fost supuse unei intervenții chirurgicale pentru îndepărtarea tumorii.
Analizele de laborator au arătat că EPA a fost eficient în blocarea căii IDO1 de degradare a triptofanului, dar această acțiune a declanșat un șir separat de evenimente, care au afectat eficacitatea tratamentului. În general, reducerea activității tumorale a fost pusă pe seama creșterii producției de nicotinamidă adenin dinucleotidă (NAD+). Combinarea terapiei, prin adăugarea la schema inițială de tratament a unui medicament antagonist conceput pentru a interfera cu receptorii purinergici a condus la o supraviețuire îmbunătățită într-un model preclinic de șoarece de cancer ovarian.
sursa: Science Daily
foto: Odată cu tratament, celulele tumorale au avut mai multe proteine HLA-DR și IDO-1 (împreună, prezentate în galben), sugerând o inflamație locală crescută și activitate antitumorală. Credit: Sebastiano Battaglia
Data actualizare: 18-03-2022 | creare: 18-03-2022 | Vizite: 529
Bibliografie
New insights into how tumors metabolically adapt to their environment may lead to better cancer therapies, link: https://www.sciencedaily.com/releases/2022/03/220316145827.htm ©
Copyright ROmedic: Articolul se află sub protecția drepturilor de autor. Reproducerea, chiar și parțială, este interzisă!
Alte articole din aceeași secțiune:
- Noutăți în relația dintre contraceptivele hormonale și riscul de cancer mamar
- Un nou studiu identifică multiple medicamente eficiente împotriva cancerul vezicii urinare
- Spune-mi unde este localizată grăsimea corporală, să-ți spun care este riscul de cancer!
- Cercetătorii au descoperit gena care previne cancerul la elefanți
Din Biblioteca medicală vă mai recomandăm:
Din Ghidul de sănătate v-ar putea interesa și:
Forumul ROmedic - întrebări și răspunsuri medicale:
Pe forum găsiți peste 500.000 de întrebări și răspunsuri despre boli sau alte subiecte medicale. Aveți o întrebare? Primiți răspunsuri gratuite de la medici.- Cancer ovarian
- O fi cancer ovarian?
- Simptome cancer ovarian!
- Diferente cancer ovarian si cancer la san
- Carcinom ovarian. Boala rediciveaza?
- Cancer ovarian?
- Carcinom ovarian.. cat de grav e si ce se poate face?
- Carcinom ovarian
- Marker tumoral HE4 / scor Roma