Temperaturile scăzute pot declanșa proteine metamorfice
©
Autor: Airinei Camelia
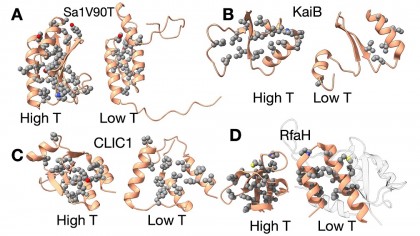
Proteinele metamorfice pot fi comparate cu niște „metamorfi” la nivel molecular, întrucât balansează între două conformații radical diferite. La ora actuală, puține astfel de proteine sunt documentate oficial (sub 100), în timp ce majoritatea proteinelor cunoscute (peste 200.000) sunt monomorfice și au un singur mod stabil de a se plia. În ciuda numărului redus, proteinele metamorfice îi atrag tot mai mult pe cercetători deoarece aceste două stări structurale distincte pot îndeplini roluri diferite în organism, făcându-le extrem de versatile.
Până recent, factorii care determină plierea alternativă a proteinelor metamorfice erau puțin înțeleși. Deși existau indicii că pH-ul, oxido-reducerea sau alte proprietăți chimice pot interveni în schimbarea formei, noile observații sugerau că și temperatura este un „trăgaci” deosebit de important. Acest element adaugă o nouă dimensiune în explicarea echilibrului dintre stările alternative ale unei proteine metamorfice.
Observații cheie din studiile recente
Dependența de temperatură
Într-un studiu anterior (2023), o proteină proiectată în laborator s-a dovedit a trece înainte și înapoi între două plieri distincte atunci când temperatura era modificată într-un interval relativ îngust (între aproximativ 5 și 30 de grade Celsius). Astfel, chiar și mici variații termice pot „înclina balanța” între cele două conformații.Rolul contactelor hidrofobe
Analizând 26 de perechi de proteine metamorfice, cercetătorii au constatat că diferențele dintre conformații implică deseori numărul și organizarea interacțiunilor hidrofobe (porțiuni care resping apa și astfel stabilizează structura). Starea proteică la temperaturi mai joase tinde să aibă mai puține contacte hidrofobe, ceea ce o face mai flexibilă, deci predispusă la schimbarea formei.Mecanism posibil universal
Ipoteza autorilor este că efectul de „cold-denaturation” (denaturare la rece) - prin care o proteină se desface parțial la temperaturi scăzute - poate fi un principiu general pentru proteinele metamorfice. Astfel, chiar dacă proteina răspunde și la alți factori (pH, stres oxidativ etc.), structura de bază a acestor proteine rămâne puternic influențată de schimbările de temperatură.Identificarea și proiectarea de noi proteine metamorfice
Observațiile privind controlul prin temperatură pot ghida cercetătorii în a descoperi mai multe proteine metamorfice în natură. Unele proteine catalogate drept „monomorfice” ar putea fi, de fapt, metamorfice dacă ar fi studiate în condiții de temperatură potrivite. În plus, descoperirile acestea sugerează că ar fi posibil să proiectăm în viitor proteine switchabile, care să își modifice funcția în funcție de mediu. O aplicație ipotetică: o „proteină-stealth” ar putea păcăli o celulă canceroasă mimând o stare inofensivă, iar apoi, odată ajunsă în interiorul celulei, să își schimbe structura și să distrugă celula tumorală.Relevanță în biomedicină și biotehnologie
Înțelegerea mai clară a modului în care proteinele metamorfice își schimbă forma este atractivă pentru:- Terapie targetată: proiectarea unor molecule care își pot modifica structura pentru a ataca selectiv un anumit tip de celulă sau pentru a neutraliza un anumit factor patogen.
- Farmacologie: optimizarea stabilității și funcționalității unor proteine în condiții extreme de mediu (de pildă, temperaturi scăzute).
- Bioinginerie: folosirea principiului metamorfismului pentru a dezvolta materiale biologice inteligente, capabile să răspundă la variații ușoare de temperatură.
Concluzii și direcții viitoare
Teoria conform căreia temperatura joacă un rol central în echilibrul dintre diferitele conformații ale proteinelor metamorfice este încă în stadiul de ipoteză, dar rezultatele de până acum o susțin consistent. În viitor, cercetătorii urmăresc să testeze mai multe proteine care, sub acțiunea temperaturii, ar putea dezvălui adevărata lor natură metamorfă.Această perspectivă deschide calea spre:
- O mai bună previzionare a proteinelor care pot prezenta metamorfie, pe baza modelelor lor structurale și a sensibilității la temperatură.
- Proiectarea de noi proteine cu mai multe stări, utile atât în cercetarea fundamentală, cât și în aplicații medicale sau industriale.
- Îmbunătățirea înțelegerii evoluției - modul în care proteinele au încorporat abilitatea de a se plia în moduri multiple și de ce temperatura este un factor atât de universal.
Prin urmare, demonstrarea mai clară a felului în care temperaturile scăzute pot modula replierea proteică și pot declanșa trecerea între stări diferite constituie un pas major în domeniul biochimiei și biologiei structurale. Oricât de îndrăzneață ar fi ideea, dacă se confirmă pe un eșantion suficient de larg de proteine, am putea asista la o nouă paradigmă în proiectarea și utilizarea proteinelor cu funcții variabile în funcție de mediu.
Data actualizare: 18-03-2025 | creare: 18-03-2025 | Vizite: 203
Bibliografie
Andy LiWang, John Orban. Unveiling the cold reality of metamorphic proteins. Proceedings of the National Academy of Sciences, 2025; 122 (12) DOI: 10.1073/pnas.2422725122Foto: University of Maryland
©
Copyright ROmedic: Articolul se află sub protecția drepturilor de autor. Reproducerea, chiar și parțială, este interzisă!
Alte articole din aceeași secțiune:
Forumul ROmedic - întrebări și răspunsuri medicale:
Pe forum găsiți peste 500.000 de întrebări și răspunsuri despre boli sau alte subiecte medicale. Aveți o întrebare? Primiți răspunsuri gratuite de la medici.- Implant silicon sani
- Pentru cei cu anxietate si atacuri de panica FOARTE IMPORTANT
- GRUP SUPORT PENTRU TOC 2014
- Histerectomie totala cu anexectomie bilaterala
- Grup de suport pentru TOC-CAP 15
- Roaccutane - pro sau contra
- Care este starea dupa operatie de tiroida?
- Helicobacter pylori
- Medicamente antidepresive?
- Capsula de slabit - mit, realitate sau experiente pe oameni