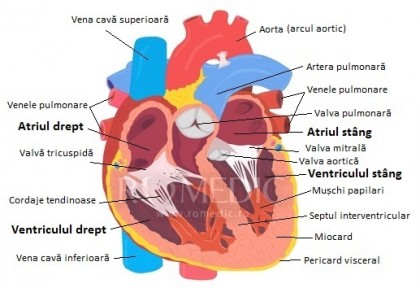
Sindromul Bland-White-Garland (ALCAPA)
Autor: Oltean Alina
Sindromul Bland-White-Garland reprezintă o malformație cardiacă congenitală rară, adesea letală în perioada de sugar, în care artera coronară stângă are origine anormală din trunchiul arterei pulmonare sau, în cazuri mai rare, din artera pulmonară dreaptă. [1] Afecțiunea mai poartă denumirea de sindrom ALCAPA, de la prescurtarea din limba engleză (Anomalous Left Coronary Artery from the Pulmonary Artery).
Această patologie a fost descrisă pentru prima dată, în anul 1933, de către Bland, White și Garland, la o femeie de 60 de ani. [2]
Originea anormală a arterei coronare stângi din artera pulmonară este cea mai frecventă malformație congenitală a circulației coronariene, cu o incidență estimată la 1 din 300.000 de nașteri. [3, 4] Mult mai rar pot emerge din trunchiul arterei pulmonare:
- artera coronară dreaptă
- artera descendentă anterioară
- artera circumflexă
- sau chiar ambele artere coronare.
Sindromul Bland-White-Garland este mult mai frecvent întâlnit în rândul sugarilor și al copiilor mici, însă există și cazuri descrise la vârstnici, [4, 5] acestea fiind rare, din cauză că aproximativ 90% dintre aceștia mor subit la o vârstă medie de 35 de ani. [6]
Anomalia poate apărea izolat sau asociată altor malformații cardiace precum tetralogia Fallot, canalul arterial persistent, defectul de sept interventricular sau coarctația de aortă.
Artera coronară stângă, cu origine anormală din trunchiul pulmonar, desprinsă cel mai adesea din sinusul stâng al arterei pulmonare [1, 8], este un vas filiform, asemănător unui conduct venos, în timp ce, artera coronară dreaptă cu origine normală din sinusul aortic este dilatată, tortuoasă, în mod ocazional, chiar anevrismală. [7, 8]
Porțiunea de ventricul stâng, perfuzată de către coronara stângă malformată, care conduce sânge venos, slab oxigenat, va fi subțire, cicatriceală și dilatată, formând uneori un anevrism ventricular. În unele cazuri, porțiunile hipoperfuzate, dar viabile, ale ventricului stâng, se hipertrofiază, din cauza multiplicării cardiomiocitelor imature, ca răspuns la hipoxie. [9] Endocardul ventricului stâng este expus la fibroelastoză și prezintă adesea calcificări focale. [7]
Tratamentul sindromului ALCAPA este exclusiv chirurgical, momentul operator fiind indicat cât mai precoce după momentul stabilirii diagnosticului.
Etiologia sindromului Bland-White-Garland
Trei teorii au fost propuse pentru a explica originea arterei coronare stângi din trunchiul arterei pulmonare. Primele două teorii sunt legate de diviziunea embriologică a trunchiului arterial comun (truncus arteriosus - vas comun care emerge din ambii ventriculi în perioada embriologică) prin dezvoltarea septului aortico-pulmonar, cu formarea ulterioară a aortei și a trunchiului arterial pulmonar. Arterele coronare își au originea embriologică în doi muguri endoteliali. Malpoziția unuia sau a ambilor muguri la nivelul porțiunii trunchiului arterial comun destinată să devină arteră pulmonară, se poate solda cu emergența anormală a arterelor coronare. În mod alternativ, o diviziune defectuoasă a trunchiului arterial poate încorpora mugurii arterelor coronare în artera pulmonară. [10]
Incidența crescută a originii anormale din trunchiul pulmonar a arterei coronare stângi, comparativ cu cea dreaptă este atribuită poziționării sinusului aortic stâng în imediata vecinătate a septului aortico-pulmonar, prin urmare, o minimă deplasare a mugurelui arterei coronare stângi este suficientă pentru a cauza încorporarea acesteia în artera pulmonară. [11]
Aceste teorii presupun formarea arterelor coronare din muguri endoteliali, care se dezvoltă înainte sau simultan cu diviziunea trunchiului arterial. Ele nu explică însă existența unei a treia artere coronare (accesorie) sau originea anormală a uneia din ramurile arterei coronare stângi din trunchiul arterei pulmonare și, de asemenea, nu explică de ce dimensiunile aortei, arterei pulmonare sau valvelor acestora nu sunt modificate ca urmare a acestei dezvoltări embriologice defectuoase.
O a treia teorie, a involuției și persistenței, are ca principiu de bază existența în perioada embriogenezei a șase artere coronare, trei având originea în aortă și trei în artera pulmonară. Arterele coronare destinate să aibă origine normală, se consideră că emerg din două buzunărașe diferite ale sinusului aortic, în timp ce celelalte artere coronare vor fi supuse unui proces de involuție. [11] Conform acestei teorii, proveniența anormală a arterei coronare stângi sau drepte, poate rezulta prin persistența unui mugure al arterelor coronare cu origine în trunchiul pulmonar asociată cu involuția mugurelui coronar aortic (în mod normal persistent).
Patofiziologie
Ischemia miocardică este o consecință serioasă a anomaliei Bland-White-Garland. La baza ischemiei nu stă faptul că doar o arteră coronară provine din aortă, deoarece consecințele funcționale ale existenței unei artere coronare unice congenital sunt în general benigne [12, 13]. Nici perfuzia coronarei anormale cu sânge slab oxigenat, provenit din artera pulmonară nu este o explicație satisfăcătoare, deoarece în malformațiile cardiace congenitale cianogene, concentrația oxigenului în sângele coronarian poate fi extrem de scăzută, fără să cauzeze ischemie miocardică.De ce mușchiul cardiac devine ischemic, atunci când artera coronară stângă provine din trunchiul arterei pulmonare?
Răspunsul stă în direcția fluxului sangvin în patul coronarian. În timpul perioadei fetale, precum și în perioada neonatală precoce, presiunea pulmonară crescută, determină un flux anterograd prin artera coronară stângă, originară din artera pulmonară, asigurând o oarecare perfuzie miocardică. Scăderea subsecventă a presiunii pulmonare, așa cum se întâmplă, în mod normal, după naștere, este însoțită de o scădere a presiunii de perfuzie a arterei coronare stângi, cu reducerea consecutivă a fluxului sangvin, care va face ca perfuzia miocardului să depindă aproape în exclusivitate de artera coronară dreaptă. Ischemia miocardică este inevitabilă, cu excepția stabilirii unor anastomoze intercoronariene, care să asigure fluxul circulator prin artera coronară stângă, din artera coronară dreaptă. [1, 7] Anastomozele intercoronariene reprezintă conducte cu rezistență scăzută, formate între aortă și trunchiul pulmonar, fiind, în esență, fistule arterio-venoase.
Hipoperfuzia miocardică este accentuată și de fenomenul de „furt miocardic” prin realizarea unui flux circulator retrograd din artera coronară stângă spre artera pulmonară.
Patofiziologia sindromului Bland-White-Garland depinde de diferența de presiune dintre circulația sistemică și circulația pulmonară, de prezența sau absența anastomozelor dintre sistemul arterial coronarian stâng și cel drept [1], precum și de vârsta pacientului, de rapiditatea închiderii canalului arterial și de gradul ischemiei miocardice. [8]
Au fost descrise patru stadii patofiziologice în sindromul ALCAPA:
- stadiul 1 – în perioada neonatală, rezistența vasculară pulmonară este crescută, presiunile sistemică și pulmonară fiind aproximativ egale, prin urmare perfuzia arterei coronare stângi anormale este adecvată, în ciuda saturației în oxigen scăzute a sângelui venos, fără apariția semnelor de ischemie miocardică sau disfuncție ventriculară stângă;
- stadiul 2 – odată cu scăderea fiziologică a rezistenței pulmonare, și prin urmare a presiunii arteriale pulmonare, perfuzia prin artera coronară stângă devine inadecvată, cu dezvoltarea unui sistem anastomotic intercoronarian prin care sângele din artera coronară dreaptă ajunge în artera coronară stîngă; acest flux sangvin însă, odată ajuns în coronara stângă întâlnește rezistențele crescute ale miocardului ventricular stâng, care determină trecerea retrogradă a sângelui spre artera pulmonară (care are rezistență scăzută) realizând așa-numitul șunt stânga-dreapta; astfel apar semne de ischemie miocardică sau chiar infarct;
- stadiul 3 – întâlnit la 10-15% din cazuri, constă în existența unui sistem anastomotic intercoronarian bine dezvoltat, capabil să mențină perfuzia miocardică optimă, cu minimă afectare miocardică, manifestată adesea în perioada adultă;
- stadiul 4 – în cele din urmă, sistemul colateral coronarian devine insuficient, cu apariția fluxului retrograd în artera coronară stângă și ischemie sau infarct miocardic subsecvent. [8]
Tulburările fiziopatologice și clinice sunt consecințe ale ischemiei miocardice. Acestea constau în disfuncția ventriculului stâng, la trei nivele:
- (1) scăderea contractilității, prin compromiterea miocardului viabil, urmare a ischemiei;
- (2) regurgitare mitrală, consecință a ischemiei mușchiului papilar, dilatării inelului valvular sau fibrozei miocardice extensive;
- (3) creșterea fluxului prin anastomozele intercoronariene, care determină supraîncărcarea ventriculului stâng. [7]
Tablou clinic
Există trei aspecte clinice generale în sindromul Bland-White-Garland:
- (1) simptomatologie intensă, cu deces înainte de vârsta de 1 an;
- (2) simptomatologie instalată precoce, cu atenuare ulterioară până la dispariție;
- (3) absența simptomelor, cu supraviețuire până în perioada adultă, fiind înregistrate supraviețuiri chiar până la vârste înaintate. [7]
Nou-născuții cu origine anormală a arterei coronare stângi sunt expuși unui risc crescut de moarte subită. Dezvoltarea unui infarct miocardic acut sau a fibrozei miocardice difuze, ca urmare a ischemiei, conduc frecvent la instalarea insuficienței cardiace. [1]
În proporție de 80-90% din născuții cu sindrom ALCAPA mor în primul an de viață, în situația în care malformația nu este recunoscută și corectată. [7]
Prezența simptomelor imediat după naștere este neobișnuită, deoarece rezistențele pulmonare, încă crescute din viața intrauterină, asigură fluxul circulator prin artera coronară stângă. În general, nou-născuții sunt aparent sănătoși la naștere, menținându-se așa până la 2-3 luni, când odată cu scăderea rezistenței vasculare pulmonare și scăderea fluxului prin artera coronară stângă, începe manifestarea bolii cu:
- dispnee
- iritabilitate
- wheezing
- tuse
- diaforeză
- paloare [7]
- tahicardie [1]
- agitație (corespondent al anginei pectorale la adult)
Simptomele sindromului ALCAPA sunt accentuate în timpul alăptării, plânsului sau accentuării tranzitului intestinal.
Uneori, simptomul inaugural, poate fi răgușeala, considerată de multe ori, urmarea compresiei nervului laringian recurent de către artera pulmonară dilatată. [14]
Instalarea insuficienței cardiace congestive este responsabilă de lipsa de creștere și dezvoltare, fiind de obicei cauza decesului. Peste o treime din cazuri prezintă moarte subită cardiacă. [7]
Aproximativ 15% din cazurile cu origine anormală a arterei coronare stângi din artera pulmonară ajung la maturitate fără simptome [7], cu apariția ulterioară a dispneei, anginei, sincopei sau morții subite cardiace.
Asocierea sindromului Bland-White-Garland cu alte malformații cardiace congenitale, care determină hipertensiune pulmonară, poate întârzia apariția simptomelor, datorită asigurării unui flux adecvat prin artera coronară stângă, întârziind, de asemenea, stabilirea diagnosticului corect. Odată însă, cu corectarea malformațiilor asociate, apare demascarea anomaliei și decompensarea gravă a cordului.
Diagnostic
La palparea pulsului periferic, se evidențiază un puls alternant (amplitudine neregulată a undelor, fiecare pulsație normală fiind urmată de una mai slabă și mai redusă ca volum), urmare a insuficienței ventriculare stângi. [7]Presiunea arterială diastolică poate fi scăzută, din cauza trecerii unei părți a sângelui aortic în fistulele arterio-venoase. [7]
Pulsul venos jugular este crescut în prezența insuficienței cardiace congestive. [7]
La auscultație, pot exista sufluri sistolice, diastolice, sistolo-diastolice sau pot lipsi suflurile cardiace patologice. Suflul holosistolic, caracteristic insuficienței mitrale, este consecința disfuncției mușchiului papilar sau a dilatării inelului valvular. Suflul continuu (sistolo-diastolic) este dat de fluxul circulator prin anastomozele intercoronariene, fiind mai fin în sistolă și mai pronunțat în diastolă, din cauza reducerii fluxului sistolic în anastomoze prin creșterea presiunii trasmurale în timpul sistolei ventriculare. Existența unui suflu diastolic izolat este atribuită unei reduceri a fluxului sistolic intercoronarian, ca urmare a unei presiuni pulmonare crescute, datorate insuficienței ventriculare stângi sau regurgitării mitrale. Se poate auzi uneori și zgomot de galop (ritm în trei timpi), tot din cauza insuficienței ventriculare stângi și regurgitării mitrale. [7]
Electrocardiograma de suprafață în sindromul Bland-White-Garland poate înregistra trei modificări principale:
- unde Q adânci și înguste, mai ales în derivațiile DI și aVL (devin tot mai evidente, odată cu progresia bolii sau din contră, pot chiar involua);
- hipertrofie ventriculară stângă (unde S adânci în V1, V2 și unde R înalte în V5, V6), care, din punct de vedere celular, este de fapt o hiperplazie, ca urmare a replicării celulelor musculare cardiace; la baza hiperplaziei stă capacitatea cardiomiocitelor imature de a se multiplica ca răspuns la hipoxia dată de hipoperfuzia miocardului ventricular stâng (încă viabil);
- ax QRS deviat la stânga. [7]
Electrocardiograma înregistrată în timpul crizelor anginoase sau al testelor de efort dezvăluie subdenivelare de segment ST și inversia undelor T.
Radiografia toracică poate afișa o umbră cardiacă mărită, în cazul nou-născuților cu cardiomegalie sau o umbră normală în cazul copiilor mai mari și al adulților. Modificări radiologice care apar relativ constant sunt dilatarea ventriculului stâng și a atriului stâng. De asemenea, se poate observa congestie pulmonară, ca urmare a insuficienței ventriculare stângi. [7]
Ecocardiografia stabilește cu exactitate originea anormală a arterei coronare stângi din trunchiul arterial pulmonar și stabilește direcția fluxului. Determină de asemenea, dimensiunea ventriculului stâng, cinetica peretelui ventricular, fracția de ejecție și cuantifică regurgitarea mitrală. [1, 7]
Aortografia, rareori necesară în cazul copiilor mici, evidențiază doar artera coronară dreaptă care emerge din aortă. În cazul existenței unui sistem anastomotic intercoronarian bine dezvoltat, substanța de contrast poate să opacifieze și artera coronară stângă. Aortografia sau coronarografia selectivă sunt indicate mai ales atunci când ecocardiografia nu permite o bună vizualizare a arborelui coronarian.
Incidența erorilor de diagnostic asociate coronarografiei convenționale, în rândul copiilor cu anomalii ale circulației coronariene, este estimată a fi 50%. [8]
Tehnicile imagistice recente includ:
computer tomografia multislice [4, 5]
rezonanța magnetică nucleară
angio-CT coronarian. [7]
Tratament
Vindecarea sindromului Bland-White-Garland depinde exclusiv de tratamentul chirurgical curativ.
Intervenția chirurgicală este indicată cât mai repede posibil, din momentul în care s-a stabilit diagnosticul. [1, 15], în vederea evitării instalării insuficienței cardiace congestive și a fibrozei miocardice, ca urmare a perfuziei inadecvate a miocardului, accentuate de fenomenul de „furt miocardic”. Din nefericire, un număr mare de pacienți cu sindrom Bland-White-Garland, sunt diagnosticați prea târziu, când leziunile cardiace sunt masive și ireversibile, singura opțiune de tratament în aceste cazuri rămânând transplantul cardiac. [1, 8]
Obiectivul terapiei chirurgicale este realizarea unui sistem circulator bicoronarian.
Există mai multe proceduri chirurgicale care pot fi utilizate precum: ligatura arterei coronare stângi anormale, anastomoza aorto-coronariană utilizând artera subclavie, o grefă sintetică sau prin realizarea unui tunel (procedeu Takeuchi). Operația de elecție, este reimplantarea directă a arterei coronare stângi în aortă, ca urmare a îmbunătățirii expertizei chirurgicale în reimplantarea coronarelor prin operația de switch arterial (procedeu curativ pentru transpoziția de vase mari). [1]
Scintigrafia miocardică de perfuzie este gold-standardul pentru evaluarea eficacității diferitelor procedee chirurgicale curative în sindromul ALCAPA. [6]
În cazul existenței disfuncției ventriculare, se impune suport inotropic preoperator și asigurarea unei hemodinamici adecvate.
Ligatura arterei coronare stângi
Simpla ligatură a coronarei stângi cu origine anormală, este prima intervenție chirurgicală curativă practicată, cu o mortalitate înregistrată la 33%. [16]
Procedura poate fi practicată prin toracotomie stângă, fără utilizarea sistemului de circulație extracorporeală. Ligatura este indicată doar la pacienții cu șunt stânga-dreapta bine dezvoltat. [1] După deschiderea pericardului, se identifică artera coronară stângă și se disecă în apropierea originii acesteia, din trunchiul arterial pulmonar. Apoi se ocluzionează artera prin dublă ligatură, iar la final se suturează pericardul și peretele toracic, cu plasarea unui tub de dren. [1]
Mortalitatea asociată acestei proceduri s-a dovedit a fi crescută, în rândul pacienților cu dezvoltare inadecvată a circulației intercoronariene, prin urmare a fost abandonată. [8]
Anastomoza arterei subclavii stângi cu artera coronară stângă
Această procedură efectuată pentru prima dată de Meyers poate fi practicată cu sau fără circulație extracorporeală. Anastomoza poate fi termino-laterală, după ligatura coronarei stângi la origine sau termino-terminală, prin excizia arterei coronare din trunchiul pulmonar, urmată de anastomoza cu capătul arterei subclavii (defectul rămas în artera pulmonară după excizia coronarei poate fi închis cu un petic sau direct prin sutură). [1]
Acest procedeu realizat în bypass cardio-pulmonar (circulație extracorporeală) poate fi practicat fie printr-o sternotomie mediană, fie printr-o toracotomie stângă antero-laterală. Tensiunea și torsionarea arterei subclavii la origine se consideră a fi principalele dezavantaje, comparativ cu utilizarea arterei mamare interne pentru realizarea anastomozei. [1]
Singura situație în care se recurge la această procedură, folosind artera subclavie stângă sau artera mamară internă, este existența unei distanțe considerabile între ostiul arterei coronare anormale și peretele aortic adiacent, făcând imposibil transferul direct al coronarei și îngreunând practicarea procedeul Takeuchi. [8]
Reimplantarea directă a arterei coronare stângi
Aceasta reprezintă metoda de elecție pentru tratamentul chirurgical curativ al sindromului ALCAPA. Practicarea acestei proceduri se realizează în circulație extracorporeală cu hipotermie moderată. Înainte de a se trece pe circulație extracorporeală, se disecă cu grijă trunchiul arterei pulmonare. Clamparea aortei este urmată de administrare soluției cardioplegice în rădăcina aortei și trunchiului pulmonar. Substanța cardioplegică poate fi, de asemenea, introdusă direct în ostiul arterei coronare stângi, după ce acesta a fost expus, prin secționarea trunchiului pulmonar (de obicei artera coronară stângă este localizată în sinusul stâng [1, 8]).
Locul considerat optim pentru reimplantarea coronarei în aortă se marcheză cu un fir de sutură, apoi se excizează o porțiune mică, rotundă (ca un buton) din peretele aortic, suficientă pentru o anastomoză laxă. Artera coronară se excizează cu un buton de arteră pulmonară în jurul originii, urmând a fi anastomozată cu aorta.
În cazurile în care orificiul coronarei stângi este poziționat la distanță față de aortă, se poate realiza un „tunel” în continuarea arterei, din peretele posterior al trunchiului pulmonar. Sutura directă a peretelui vascular pulmonar, după excizia părții posterioare, nu este recomandată, deoarece poate aplica presiune pe artera coronară reimplantată. Din acest motiv, se preferă interpunerea unui petic de pericard autolog (prelevat de la pacient). [1]
Bypass-ul coronarian (aorto-coronarian)
Pentru efectuarea unui bypass coronarian (șuntarea zonei afectate, în vederea restabilirii fluxului circulator distal de leziune) se pot folosi grefe autologe precum vena safenă, artera subclavie, artera radială, artera mamară internă sau grefe sintetice din Dacron (mai rar utilizate), care se vor anastomoza cu artera coronară stângă, fie termino-lateral, după ligatura acesteia la origine, fie termino-terminal, în cazul secționării arterei. [1]
În general, practicarea bypass-ului este de evitat la copii, din cauza obstruării în timp a grefelor venoase utilizate. Ca alternativă, se poate folosi artera mamară internă, cu mai bune rezultate.
Tunelizarea intrapulmonară (procedeu Takeuchi)
Constă în crearea unei ferestre aorto-pulmonare și a unui flap din peretele anterior al trunchiului pulmonar, adiacent ferestrei aorto-pulmonare. Flap-ul este ulterior suturat la peretele posterior al trunchiului pulmonar și în jurul orificiului arterei coronare stângi, creându-se astfel un tunel între ferestra aorto-pulmonară și artera coronară stângă. Defectul rămas în peretele vascular pulmonar (ca urmare a realizării flap-ului) este închis cu un petic de pericard. Ca și alternative, pentru realizarea tunelului, se pot utiliza pericard [17] sau tuburi sintetice de Gore-Tex.
Procedura Takeuchi este indicată copiilor a căror anatomie nu se pretează pentru reimplantarea arterei coronare stângi. [8] Dezavantajul procedeului constă în apariția tardivă a stenozei pulmonare supravalvulare, motiv pentru care practicarea acestei tehnici este descurajată. [1]
Managementul regurgitării mitrale
Într-un studiu condus de Vouhe și colab. [18] s-a observat o îmbunătățire a funcționalității valvei mitrale, după reimplantarea coronariană chirurgicală. Persistența regurgitării mitrale poate necesita o a doua intervenție chirurgicală mai târziu.
Concluzii
- Sindromul Bland-White-Garland este o malformație cardiacă congenitală rară, însă adesea letală în primul an de viață.
- La sugarul hipotrofic, care nu prezintă o creștere în greutate corespunzătoare, trebuie luată în calcul existența unei malformații cardiace congenitale (după excluderea cauzelor alimentare și digestive).
- Sindromul Bland-White-Garland este prima cauză care trebuie investigată la un sugar cu cardiomegalie.
- Tratamentul chirurgical având rezultatele cele mai promițătoare este reprezentat de reimplantarea arterei coronare stângi.
- În lipsa tratamentului chirurgical, rata mortalității este de aproximativ 90%.
- Prognosticul, în lipsa intervenției curative, depinde de starea circulației colaterale coronariene.
- Accident ischemic tranzitor
- Reumatismul articular acut - RAA
- Angina pectorala stabila
- Infarctul miocardic
- Insuficiența cardiacă
- Atrezia tricuspidiană
- Extrasistolele ventriculare
- Tahicardia ventriculara
- Fibrilatia ventriculara
- Aritmia
- Factori de risc în bolile cardiovasculare
- Transplantul cardiac
- Sfaturi pentru sănătatea inimii
- Inima (cordul)
- Imi bate inima prea tare
- Palpitatii inima
- Intepaturi inima, mana stanga amortita
- Aritmii
- Presiune inima
- Socuri electrice la inima
- Probleme cu inima la 22 de ani?
- Batai puternice ale inima de la o simpla miscare
- Diabet, probleme cu tensiunea, inima
- Saptamana trecuta i-a intrat o sarma in picior